Inhaltsverzeichnis: |
Warum werden Tierversuche in der Forschung durchgeführt?
Grundsätzlich besteht das Ziel der Forschung darin, neues Wissen zu generieren – was, für sich gesehen, durchaus erstrebenswert ist. Wenn jedoch Tierversuche damit zusammenhängen, geschieht dies leider auf Kosten fühlender Lebewesen. In der Forschung finden solche Versuche beispielsweise im Bereich der Entwicklung neuer Medikamente, Technologien oder in der Grundlagenforschung statt. Die Ergebnisse aus Tierversuchen sind jedoch meist irrelevant, da sie nur selten auf den Menschen übertragbar sind. Somit sind diese grausamen Tierversuche weder wissenschaftlich noch ethisch zu rechtfertigen.
Machen Tierversuche Sinn?
Macht es Sinn, Tiere in Versuchslaboren einzusperren, sie vorsätzlich krank zu machen, mit Elektroschocks zu quälen, sie ersticken zu lassen oder Verhaltensexperimenten auszusetzen und anschliessend zu töten und aufzuschneiden – einfach um zu wissen, was passiert? Neue Erkenntnisse können wertvoll sein, doch der Missbrauch von Tieren im Namen der Forschung ist damit nicht zu rechtfertigen und zum Glück auch überhaupt nicht nötig.
Zudem können Tierversuche Reaktionen beim Menschen meist nicht verlässlich vorhersagen, denn die biologischen Unterschiede zwischen Mensch und Tier sind einfach zu gross, als dass sich die Ergebnisse zuverlässig vom Tier auf den Menschen übertragen liessen. Selbst Frau und Mann können auf medizinische Wirkstoffe unterschiedlich reagieren – wie sollen da Tierversuche verlässliche Ergebnisse für den Menschen liefern können? Auch bei näherverwandten Tierarten, wie bei Ratten und Mäusen, wirken Substanzen oftmals komplett unterschiedlich. Somit ist naheliegend, dass der Unterschied zum Menschen noch grösser ausfällt. Es ist nicht möglich, anhand von Tierversuchen sichere Schlussfolgerungen für den Menschen zu ziehen. Solche Versuche sind nicht nur grausam, sondern auch unwissenschaftlich und oft sogar gefährlich. [1, 2]
Grundlagenforschung
In der Schweiz werden knapp über 60 Prozent (Stand 2019) aller Tierversuche im Bereich der Grundlagenforschung durchgeführt. [3] In diesem Forschungsbereich soll das allgemeine naturwissenschaftliche und medizinische Wissen vermehrt werden. Es wird also aus «wissenschaftlicher» Neugier heraus geforscht. Neugierig nach neuem Wissen zu sein, ist grundsätzlich nicht verwerflich, wenn dafür Lebewesen leiden, allerdings schon.
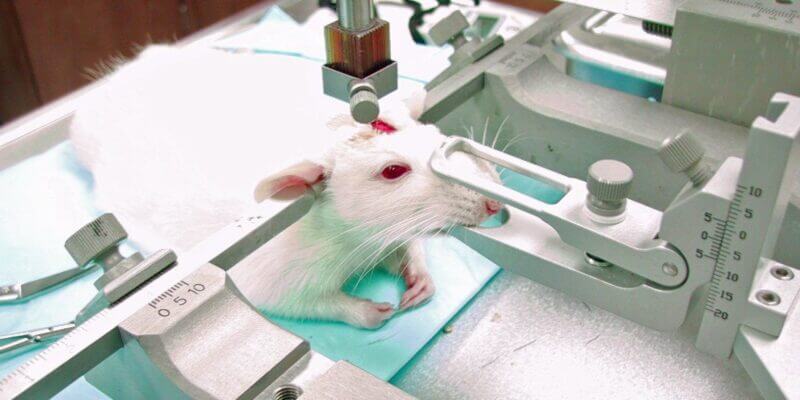
Die Grausamkeit und Absurdität der Versuche kennen dabei keine Grenzen. Zum Beispiel saugten «Forscher» Ratten einen Teil ihres Gehirns ab, um herauszufinden, welche Nerven aktiviert werden, wenn Druck auf ihre Schnurrhaare ausgeübt wird. Danach wurde eine Elektrode in den Kopf der Ratte implantiert, um Nervenimpulse bei Berührung der abgeschnittenen Schnurrhaare zu messen. [4] In einer anderen Studie wurde das Spielverhalten von Ratten untersucht – mit dem Ergebnis: Ratten haben Spass am Versteckspiel. Klingt süss – allerdings wurden den Tieren auch hierfür Elektroden ins Gehirn implantiert, und nach dem Experiment wurden sie getötet, ihr Hirn wurde entnommen und in Scheiben geschnitten. [5] In Versuchen zur Stressforschung werden Mäuse monatelang ständiger Angst und Schmerzen ausgesetzt: Sie bekommen nicht genug zu essen, werden bewegungsunfähig in enge Plastikröhren gesteckt und mit aggressiven Mäusen eingesperrt, die sie immer wieder angreifen. Mit heissen Platten und anderen Instrumenten wird ihnen Schmerz zugefügt, um ihr Verhalten zu beobachten. [6, 7]

Auch in der Schweiz werden solch ungeheure Tierversuche, die hinsichtlich der Übertragung auf den Menschen irrelevant sind, stetig durchgeführt. Beispielsweise fristen in einem Versuchslabor seit 2017 vier Makaken-Affen ein trostloses Dasein und werden für «Gehirnexperimente» der ETH und Universität Zürich missbraucht. Die «Forscher» wollen Entscheidungsprozesse im Gehirn untersuchen, wie sie bei Schizophrenie und anderen psychischen Erkrankungen vorkommen. Hierfür wurde den fühlenden Lebewesen der Schädel aufgeschnitten, um ihnen dauerhaft Elektroden ins Gehirn zu implantieren. Die Affen werden unter anderem in Primatenstühlen fixiert, in welchen sie dann Aufgaben lösen müssen. Zusätzlich werden einigen Affen durch chirurgische Eingriffe oder Medikamente verschiedene Arten von Hirnschäden zugefügt, um zu sehen, welche Auswirkungen diese erzeugten Behinderungen auf das Lösen kognitiver und motorischer Aufgaben haben, um menschliche Krankheitsbilder nachzuahmen. Nicht nur ist dies äusserst absurd und grausam: Seit Jahrzehnten verspricht die Tierversuchsforschung, dass dank solcher Affenversuche psychische oder neurologische Erkrankungen wie Schizophrenie, Alzheimer oder Parkinson geheilt werden können. Doch auch nach etlichen Jahren grausamer Versuche an unzähligen Affen ist heutzutage keine dieser Krankheiten heilbar. [8, 9]
Was das Ganze noch schlimmer macht, ist die Tatsache, dass Erkenntnisse aus der Grundlagenforschung kaum zur klinischen Anwendung kommen und ein direkter Nutzen von Tierversuchen für den Menschen oft nicht nachweisbar ist. Die Relevanz solcher Erkenntnisse steht in keinerlei Verhältnis zu dem immensen Tierleid, auf dem sie beruhen. [10, 11, 12] Daher hat die Bezeichnung der reinen «Neugierforschung» durchaus ihre Berechtigung.
Angewandte Forschung
Angewandte Forschung ist praxisbezogene Forschung, welche oft ein medizinisches Problem lösen will. Während die Erkenntnisse der Grundlagenforschung fast nie zu einer Anwendung beim Menschen führen [10, 11] und der direkte Nutzen solcher Tierversuche für den Menschen nicht nachweisbar ist [12], ist der Einsatz beim Menschen bei der angewandten medizinischen Forschung nahezu direkt vorgelagert. Ergebnisse aus der angewandten Forschung sollen beispielsweise die Medikamentenentwicklung direkt unterstützen.
Bei Tieren werden Schlaganfälle ausgelöst, ihre Gene werden manipuliert und dadurch künstlich krank gemacht oder ihnen werden Krebszellen implantiert. Dabei sind die Misserfolgsquoten enorm: Für die Zulassung neuer Medikamente zur Behandlung von Krebs [13] bzw. Alzheimer [14] liegt diese bei 96,6 bzw. 99,6 Prozent, bei der Schlaganfall-Forschung sogar bei 100 Prozent (bei 1‘000 neuen an Tieren getesteten Wirkstoffen und 100 klinischen Studien). [15, 16]

Seit den 1980ern wird beispielsweise an Hunden geforscht, um eine Heilmethode für Muskelschwund bzw. -dystrophie (MD) zu finden. Die Tiere, denen gezielt lähmende Muskelerkrankungen angezüchtet wurden, können nur unter grosser Anstrengung schlucken, gehen und atmen – und sterben meist an den Folgen der Erkrankung. Doch auch Jahrzehnte dieser Forschung mit missbrauchten Hunden haben noch keine Therapie- oder Heilungsmöglichkeit für Menschen mit dieser schrecklichen Krankheit hervorgebracht. Denn die künstlich erzeugte Muskelerkrankung der Hunde ist schlichtweg nicht mit MD beim Menschen vergleichbar. Eine Analyse von Studien zu MD an Hunden hat gezeigt, dass eine Übertragung der Ergebnisse auf den Menschen nicht nur nutzlos, sondern sogar irreführend ist, denn in einigen Studien kommt es beim Menschen zu völlig entgegengesetzten Ergebnissen. Heutzutage gibt es bereits bessere Möglichkeiten, um Patienten mit MD mit verschiedenen, innovativen, humanrelevanten Techniken zur Entwicklung von Therapien zu verhelfen.
Oftmals werden medizinische Errungenschaften als Argument für die angebliche Notwendigkeit von Tierversuchen angeführt. Es gibt jedoch etliche Beispiele, bei denen Tierversuche den medizinischen Fortschritt behinderten: Bei der Erforschung von Polio (Kinderlähmung) zum Beispiel wurde lange der falsche Infektionsweg untersucht. Hätte man sich bei der Forschung auf menschliche Patienten statt Rhesusaffen konzentriert, hätte ein Impfstoff deutlich schneller gefunden werden können. [17] Tierversuche waren zwar an vielen Forschungsergebnissen beteiligt, jedoch bedeutet dies nicht, dass diese Erkenntnisse nicht auch mit tierfreien Methoden hätten erreicht werden können. Einzelne medizinische Erfolge ändern nichts daran, dass Tierversuche unzuverlässig sind, denn sie finden schlichtweg im falschen Organismus statt – ein Ergebnis aus Tierversuchen sagt meist nichts darüber aus, wie der menschliche Organismus reagieren wird. Es gibt bereits etliche tierfreie Methoden, die tatsächlich für den Menschen relevante Resultate liefern. Die Fortschritte in diesem Bereich sind zwar rasant, doch die Entwicklung und Validierung dieser zuverlässigen Methoden wird nicht stark genug gefördert.
Wie funktioniert die Zulassung eines neuen Medikaments?
Durchschnittlich dauert es zehn bis fünfzehn Jahre, bis ein Medikament auf den Markt kommt. Die Kosten belaufen sich auf zwei Milliarden Schweizer Franken. Einer der Schritte auf dem Weg zur Zulassung eines neuen Medikaments ist die präklinische Prüfung neuer Wirkstoffe, die unter anderem in Tierversuchen erfolgt. Hierbei wird geschaut, ob ein Wirkstoff tatsächlich wirkt und ob er ein menschliches Sicherheitsrisiko darstellen könnte. Das ist schon das erste Problem, denn anhand von Ergebnissen aus Tierversuchen lassen sich keine verlässlichen Aussagen für den Menschen treffen. Mindestens 30 Prozent der toxischen Effekte, die beim Menschen auftreten, wurden durch Tierversuche nicht vorhergesagt. [18]
Wenn ein Wirkstoff im Tierversuch als wirksam und sicher befunden wurde, folgen klinische Studien, die in Phase I (bzw. 0) bis Phase IV unterteilt werden. In der ersten Phase werden allerdings nur etwa zehn Personen getestet. Wieso? Weil der vorhergehende Tierversuch keine Garantie dafür gibt, dass ein Wirkstoff verträglich und sicher ist. In einer klinischen Studie der Phase I beispielsweise wurde Probanden der immunomodulatorische Wirkstoff TGN1412 verabreicht, und zwar in einer Dosis, die 500 Mal geringer war als die in Tierversuchen als sicher eingestufte Dosis [19]. Dennoch befanden sich 2006 alle sechs Probanden in lebensbedrohlichem Zustand, eine Person lag sogar im Koma. Somit wird eigentlich jeder neue Wirkstoff «am Menschen getestet». Da seltene Nebenwirkungen erst in breiter Anwendung entdeckt werden, werden viele Wirkstoffe in späteren klinischen Phasen aussortiert.
Bis zu 95 Prozent aller medizinischer Wirkstoffe, die im Tierversuch funktionieren und als sicher eingestuft werden, kommen niemals auf den Markt, unter anderem weil das Medikament in den klinischen Studien beim Menschen nicht wirkt oder teils sogar gefährliche Nebenwirkungen auftreten. [20] Für bestimmte Krankheiten wie Krebs, Alzheimer oder Schlaganfall ist die jeweilige Misserfolgsquote mit zwischen 96,6 und 100 Prozent noch grösser. [13, 14, 15, 16]
Tierversuchsfreie Methoden
Der «Organ-on-a-chip» ist ein Testsystem, das die natürliche physiologische Umgebung von Organen widerspiegelt. Verschiedene solcher Mini-Organe können mit einem Blutgefäss-ähnlichen System verbunden werden und liefern so genauere Ergebnisse. Testsysteme mit vier miteinander verbundenen Organen sind bereits breitflächig verfügbar. Bestrebungen laufen, um alle menschlich relevanten Organe in Miniaturformat zu einem Organismus zusammenzufügen – einem «Human-on-a-chip». Damit werden Testsubstanzen den kompletten simulierten menschlichen Körper durchlaufen können. [21]
In-silico-Verfahren (Computersimulationen) können unter anderem die menschliche Biologie und das Fortschreiten sich entwickelnder Krankheiten simulieren. [22] So können diese ausgeklügelten computergestützten Techniken etwa vorhersagen, wie neue Medikamente im menschlichen Körper reagieren und wie sie abgebaut und ausgeschieden werden. [23]
Organoide sind aus menschlichen Zellen gezüchtete Organe in Mini-Format. Mit dieser Methode konnten schon einige Erfolge erzielt werden: Zum Beispiel konnten Wissenschaftler durch die Nutzung von Hirn-Organoiden eine potenzielle Ursache für tödliche Hirnmissbildungen finden, die durch eine seltene genetische Störung ausgelöst werden. Diese als Miller-Dieker-Syndrom bekannte Störung war zuvor bereits ohne Erfolg an Mäusen getestet werden. [24]
Personalisierte Medizin rückt immer mehr in den Fokus. Da sich die Wirkung von Medikamenten oft selbst von Person zu Person unterscheidet, lässt sich nur schwer voraussagen, ob ein Medikament einem bestimmten Patienten tatsächlich hilft oder vielleicht sogar zu seltenen Nebenwirkungen führt. Deshalb könnte durch die Analyse der kompletten DNA ein «digitaler Zwilling» angelegt werden, um geplante Behandlungen durchzuspielen. Auch können Zellen des Patienten direkt für Organoide oder in Multiorganchips verwendet werden, sodass die Wirkung eines Medikamentes zuerst getestet werden kann, bevor es dem Patienten verabreicht wird (z. B. bei Chemotherapien). [25]
Auch die Methode der induzierten pluripotenten Stammzellen (iPSC) eröffnet viele Möglichkeiten. Dabei werden einem Patienten Haut- oder Haarzellen entnommen und in Stammzellen umgewandelt, mit denen dann Zellen von verschiedenen Organen gezüchtet werden können. So ist es Biotechnologen beispielsweise gelungen, aus menschlichen Stammzellen voll funktionierende Blutgefässe zu kultivieren. Diese ein Millimeter grossen Kapillargebilde ermöglichen erstmals die Erforschung von Erkrankungen der Blutgefässe direkt an menschlichem Gewebe. Dies weckt unter anderem bei Diabetikern Hoffnung auf neue, wirksame Medikamente. [26, 27]
Die Zukunft ist tierversuchsfrei
Es ist längst überfällig, dass wir uns von Tierversuchen abwenden und von humanrelevanten, tierleidfreien Methoden Gebrauch machen. Heutzutage gibt es in vielen Bereichen zahlreiche solcher Methoden – einige bereits erfolgreich im Einsatz, andere weit entwickelte und vielversprechende Ansätze, die endlich mit ausreichend Fördergeldern unterstützt werden sollten, damit sie präzisiert und einsatzfähig gemacht werden können.
Es ist höchste Zeit, uns endlich effizienten und modernen tierversuchsfreien Testmethoden zuzuwenden, um relevante und zuverlässige Ergebnisse zu erzielen, ohne weiterhin furchtbares Leid zu verursachen. Unterstützen Sie die Kampagne «Wissenschaft statt Tierversuche» unserer Partnerorganisation PETA Deutschland und werden Sie Teil einer wissenschaftlichen Revolution!
Was Sie tun können
Bitte kaufen Sie keine Produkte, für die Tierversuche durchgeführt oder in Auftrag gegeben wurden. Informieren Sie auch Familie, Freunde und Bekannte über die vorherrschenden Missstände in Versuchslaboren, die Misserfolgsquoten von Tierversuchen und den notwendigen systematischen Wechsel zu tierversuchsfreien Methoden.
-
Quellen
[1] Gottmann, E., 2001: Data Quality in Predictive Toxicology: Reproducibility of Rodent Carcinogenicity Experiments. Environmental Health Perspectives, vol. 109, pp. 509-514.
[2] Hartung, T., 2009: Toxicology for the twenty-first century. Nature, vol. 460, pp. 208-212.
[3] Bundesamt für Lebensmittelsicherheit und Veterinärwesen: Tierversuche, https://www.blv.admin.ch/blv/de/home/tiere/tierversuche.html, (eingesehen am 08.10.2020)
[4] Stüttgen, M.C. et al., 2008: Responses of rat trigeminal ganglion neurons to longitudinal whisker stimulation. Journal of Neurophysiology, vol. 100, pp. 1879-1884.
[5] Reinhold, A.S. et al., 2019: Behavioral and neural correlates of hide-and-seek in rats. Science, vol. 365, pp. 1180–1183.
[6] Lomazzo, E. et al., 2017: Chronic stress leads to epigenetic dysregulation in the neuropeptide-Y and cannabinoid CB1 receptor genes in the mouse cingulate cortex. Neuropharmacology, vol. 113, pp. 301–313
[7] Lomazzo, E. et al., 2015: Therapeutic Potential of Inhibitors of Endocannabinoid Degradation for the Treatment of Stress-Related Hyperalgesia in an Animal Model of Chronic Pain. Neuropsychopharmacology, vol. 40, pp. 488–501
[8] SRF: Vier Affen üben das Hirnexperiment, https://www.srf.ch/news/regional/zuerich-schaffhausen/tierversuche-an-der-uni-zuerich-vier-affen-ueben-das-hirnexperiment, (eingesehen am 09.10.2020)
[9] Aktionsgemeinschafe Schweizer Tierversuchsgegner (AGSTG): Neue Affenversuche an der Uni und der ETH Zürich, https://www.agstg.ch/magazin/magazin-archiv/77-/albatros-43/421-neue-affenversuche-an-der-uni-und-der-eth-zuerich.html, (eingesehen am 09.10.2020)
[10] Chalmers, I. et al., 2014: How to increase value and reduce waste when research priorities are set. The Lancet, vol. 383, issue 9912, pp. 156–165.
[11] Pound, P. & M.B. Bracken, 2014: Is animal research sufficiently evidence based to be a cornerstone of biomedical research? British Medical Journal, vol. 348.
[12] Pound, P. et al., 2004: Where is the evidence that animal research benefits humans? British Medical Journal, vol. 328, pp. 514-517.
[13] Collins, F.S. & L.A Tabak, 2014: Policy: NIH plans to enhance reproducibility. Nature, vol. 505, no. 7485, pp. 612-613.
[14] Freedman, L.P. et al., 2015: The economics of reproducibility in preclinical research. PLoS Biology, vol. 13, no. 6.
[15] Roth, S. & A. Liesz, 2016: Stroke research at the crossroads – where are we heading? Swiss medical weekly, vol. 146.
[16] Kikuchi, K. et al., 2014: Clinical trials in acute ischemic stroke. CNS drugs, vol. 28, no. 10, pp. 929-938.
[17] Deutsches Referenzzentrum für Ethik in den Biowissenschaften: Poliomyelitis, http://www.drze.de/im-blickpunkt/tierversuche-in-der-forschung/module/poliomyelitis-kinderlaehmung, (eingesehen am 08.10.2020)
[18] Greaves, P., Williams A., Eve M., 2004: First dose of potential new medicines to humans: how animals help. Nature Reviews Drug Discovery, vol. 3, pp. 226–236.
[19] Attarwala H. TGN1412: From discovery to disaster. J Young Pharm. 2010;2(3):332-336. http://www.jyoungpharm.org/article/494, (eingesehen am 15.10.2020)
[20] National Center for Advancing Translational Sciences (NCATS). About NCATS, https://ncats.nih.gov/about., (eingesehen am 08.10.2020)
[21] MEDICA Magazin: Organ-on-a-chip – Organe im Miniaturformat, https://www.medica.de/de/News/Thema_des_Monats/%C3%84ltere_Themen_des_Monats/Themen_des_Monats_2019/Organ-on-a-chip/Organ-on-a-chip_-_Organe_im_Miniaturformat#:~:text=Eine%20vielversprechende%20Alternative%20sind%20Organ,Krankheitsursachen%20und%20Therapieans%C3%A4tze%20erforscht%20werden, (eingesehen am 15.10.2020)
[22] Aguda, B.D. et al., 2011: An In Silico Modeling Approach to Understanding the Dynamics of Sarcoidosis. PLoS One, vol. 6, issue 5, e19544
[23] Martonen, T. et al., 2003: In silico modeling of asthma. Advanced Drug Delivery Reviews, vol. 55, issue 7, pp. 829-849
[24] Bershteyn, M. et al., 2017: Human iPSC-Derived Cerebral Organoids Model Cellular Features of Lissencephaly and Reveal Prolonged Mitosis of Outer Radial Glia. Cell Stem Cell, vol. 20, no. 4, pp. 435-449.
[25] MEDICA Medizin: Personalisierte Medizin – zielstrebig zur Heilung, https://www.medica.de/de/News/Thema_des_Monats/%C3%84ltere_Themen_des_Monats/Themen_des_Monats_2018/Personalisierte_Medizin/Personalisierte_Medizin_%E2%80%93_zielstrebig_zur_Heilung, (eingesehen am 15.10.2020)
[26] Wissenschau.de: Induzierte pluripotente Zellen: Stammzellen aus dem Labor, https://www.wissensschau.de/stammzellen/ips_zellen.php, (eingesehen am 15.10.2020)
[27] Proceedings of the National Academy of Sciences of the United States of America: Generation of functionally competent and durable engineered blood vessels from human induced pluripotent stem cells, https://www.pnas.org/content/early/2013/07/16/1310675110.long, (eingsehen am 15.10.2020)